Absorptie versus adsorptie

Inhoud
- Inhoud: Verschil tussen absorptie en adsorptie
- Wat is absorptie?
- Wat is adsorptie?
- Belangrijkste verschillen
Het belangrijkste verschil tussen absorptie en adsorptie is, absorptie is het proces waarbij vloeistof wordt opgelost door vaste of vloeibare vloeistof. Integendeel, adsorptie is het proces waarbij ionen, moleculen of atomen van een stof zoals gas, vast of vloeibaar, zich hechten aan het oppervlak van het adsorbens.
Inhoud: Verschil tussen absorptie en adsorptie
- Wat is absorptie?
- Wat is adsorptie?
- Belangrijkste verschillen
- Video uitleg
Wat is absorptie?
Absorptie is een proces waarbij de ene stof volledig in een andere stof komt. Het is een proces waarbij een atoom of molecuul wordt opgezogen in een volume van andere moleculen. Het moet deel uitmaken van de substantie door er volledig in te gaan. Het kan een chemisch of fysisch proces zijn. Koolstofdioxide kan bijvoorbeeld worden opgenomen in de oplossing van kaliumcarbonaat. Dit is een voorbeeld van chemische absorptie, omdat een reactie plaatsvindt. Een ander voorbeeld zou lucht in water kunnen oplossen. Dit is fysieke absorptie, omdat lucht het water binnenkomt door evenwichtsdruk. Wanneer een stof of materiaal een bepaalde hoeveelheid vloeistof of gas in zich opzuigt, zou dat materiaal het andere materiaal hebben geabsorbeerd. Daarom beweegt er in absorptie iets in een materiaal.
Wat is adsorptie?
Adsorptie is het proces waarbij gas of vloeistof niet wordt geabsorbeerd maar alleen over het oppervlak wordt gevormd. Om synthetische redenen en waterzuivering wordt het fenomeen adsorptie veel gebruikt in de industrie. Het houdt hechting in. Een substantie hangt in dit proces gewoon vast aan de andere substantie zonder erin te gaan. Koolstofdioxide bevindt zich bijvoorbeeld op het oppervlak van het adsorbens binnenin de druk-schommeling adsorberende eenheid. Het bevindt zich op het oppervlak van het vaste adsorbens.
Belangrijkste verschillen
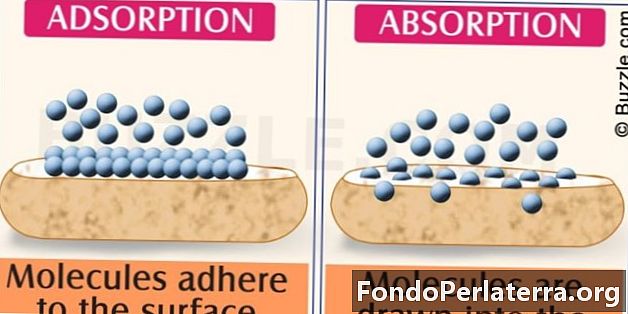
- Assimilatie van moleculaire soorten door bulk van vaste of vloeibare stoffen wordt absorptie genoemd. Accumulatie van moleculaire soorten aan het oppervlak en het niet aangaan ervan wordt adsorptie genoemd.
- Absorptie is een bulkfenomeen terwijl adsorptie een oppervlaktefenomeen is.
- Absorptie is een endotherm proces, terwijl adsorptie een exotherm proces is.
- Absorptie wordt niet beïnvloed door temperatuur en adsorptie wordt begunstigd door lage temperatuur.
- Absorptie vindt plaats met een uniforme snelheid, terwijl de snelheid van adsorptie gestaag toeneemt en uiteindelijk het evenwicht bereikt.
- Concentratie is absorptie is hetzelfde door het hele materiaal. Concentratie op het oppervlak verschilt in adsorptie van die in de bulk.
- Absorptie wordt commercieel gebruikt in koelmachines en waterzuivering.
- Absorptie is gerelateerd aan volume, terwijl adsorptie gerelateerd is aan het oppervlak.
- Absorptie omvat oplossing en diffusie terwijl adsorptie hechting omvat.
- Bij absorptie wordt energie van een foton geabsorbeerd door een andere entiteit.